药物靶蛋白的系统鉴定在理解药物作用机制和毒副作用方面起着至关重要的作用。传统策略包括基于活性的探针分析(ABPP)和亲和色谱方法的亲和层析方法通常需要对小分子或药物进行修饰/衍生。因此,近年来开发了几种无需对药物或小分子进行修饰的方法来研究药物与蛋白质的相互作用。例如,基于氧化速率的蛋白质稳定性分析(SPROX),药物亲和力响应靶标稳定性测定(DARTS),胞内热变化测分析(CETSA)和热迁移蛋白组学方法(TPP)等。以上方法都是基于配体结合靶标蛋白后能够提高其稳定性,进而耐受氧化变性、蛋白酶水解和热变性等条件。有机溶剂能够引起蛋白变性和沉淀,利用该蛋白沉淀方法能够捕捉药物结合蛋白和未结合蛋白的稳定性差异,从而鉴定药物与蛋白之间的相互作用。因此,我们课题组发展了基于溶剂诱导蛋白质沉淀方法(SIP)用于药物靶标蛋白的筛选。相关成果以“Solvent-Induced Protein Precipitation for Drug Target Discovery on the Proteomic Scale”为题发表在国际化学权威杂志Analytical Chemistry上。(Analytical Chemistry, 2020, 92, 1363−1371;DOI: 10.1021/acs.analchem.9b04531)。
首先利用SIP方法成功鉴定到MTX和SNS-032两种模型药物的已知靶标蛋白,验证了该方法的可行性。该方法药物结合靶标的鉴定能力通过使用广谱激酶抑制剂星形孢菌素得到了进一步验证,实验结果表明,该方法鉴定到的多数稳定性变化蛋白为蛋白激酶。最后对格尔德霉素进行了系统研究,发现了该小分子的潜在脱靶蛋白NDUFV1。格尔德霉素脱靶的发现有助于了解格尔德霉素诱导的肝毒性的作用机制,并为HSP90抑制剂的设计和改造提供了信息。此外,SIP方法确定了格尔德霉素与脱靶蛋白NDUFV1之间的亲和力,说明该方法可以评估药物与相互作用靶标蛋白的亲和力。
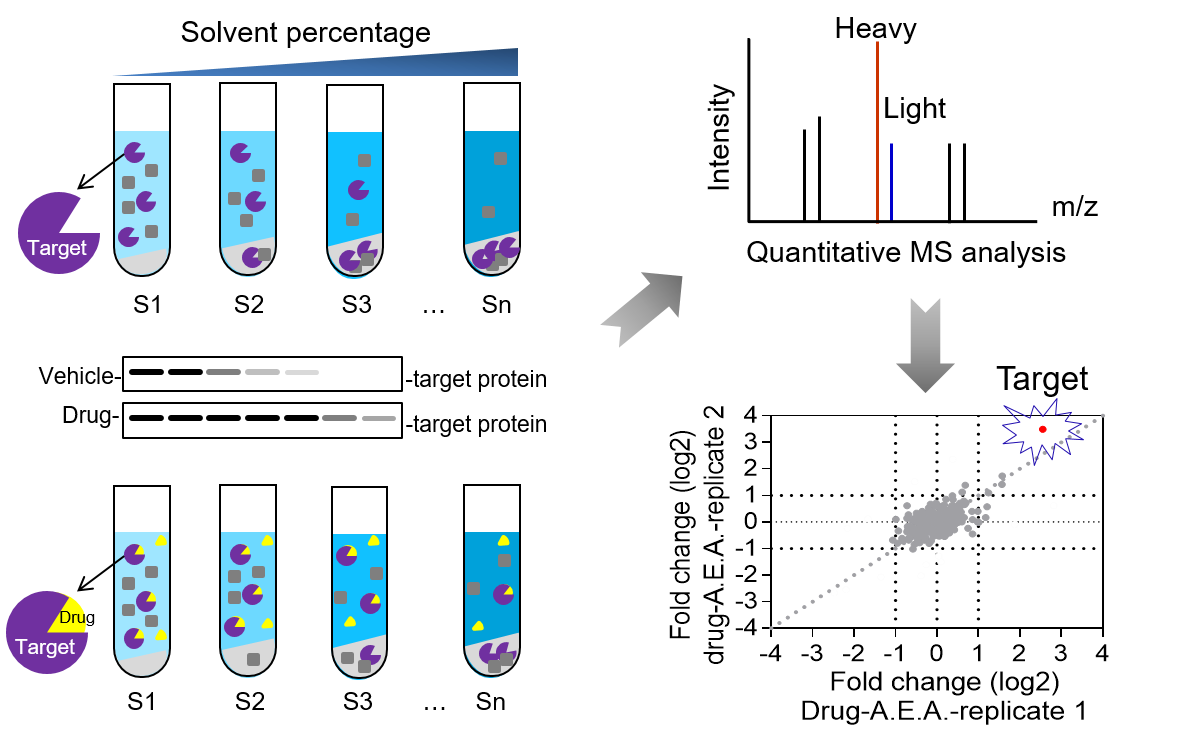
该方法简单有效,成本较低,应用范围广,能够评估配体与靶标蛋白之间的亲和力,鉴定的蛋白与TPP方法具有互补性;可以推广到多种药物和疾病细胞模型,为药物靶标的筛选、药物作用机制和毒副作用的研究以及疾病标志物的发现提供有力的工具。
该研究工作被科研公众号“王初课题组”进行推送报道。https://mp.weixin.qq.com/s/zhMN-T3LngEK9qB3AptYoA (文/图 张晓磊)