配体-蛋白相互作用的研究促进了新药开发、生物标志物发现,有助于我们更深入地理解疾病相关分子机制、细胞信号转导等与人类健康息息相关的生物学问题。针对目前基于热稳定性方法的药物靶蛋白筛选方法存在的问题,我们发展了一种微球辅助的热致蛋白沉淀方法,利用蛋白受热展开结构后易于沉积到微球材料表面的性质,使用微球材料富集热致沉淀的蛋白。利用与药物结合后靶蛋白热稳定性增强这一现象,识别药物靶蛋白。该方法能对大批量生物样品进行标准化、流线式的操作,方法可拓展性好、灵敏度高,对微量样品的兼容性好,能快速、稳健地识别药物小分子与靶蛋白之间的相互作用。相关成果以“Microparticle-assisted precipitation screening method for robust drug target identification”为题发表在国际化学权威杂志Analytical Chemistry(Analytical Chemistry, 2020, 92, 13912-13921 ;DOI: 10.1021/acs.analchem.0c02756)上。
多数情况下,药物分子通过与其直接靶蛋白发生特异性结合,调节靶蛋白的结构性质、影响直接结合蛋白和下游蛋白的生物功能,从而达到治疗效果。目前药靶筛选领域常用的热蛋白质组分析方法通过测定药物结合靶蛋白的热稳定性变化来进行药物靶蛋白筛选。针对热蛋白质组分析方法所需要的细胞样品起始量大、不适合大规模样品批量处理等问题,我们发展了一种微球辅助的热致沉淀蛋白质组方法(MAPS),通过检测加药/空白处理下微球捕获的沉淀样品之间的蛋白定量差异,即可推断与药物发生直接相互作用的靶蛋白。由于在样品前处理阶段引入了微球材料,MAPS方法操作简便、可拓展性好,加热、烷基化、酶解等样品前处理过程都可在微球表面上操作,这一流线式的MAPS工作流程使得快速高通量的药靶筛选成为可能。在低至20 μg起始蛋白量的微量样品分析中,我们将该方法应用到多种临床药物(包括甲氨蝶呤,雷替曲塞,环孢菌素A,SHP099)的靶蛋白研究,使用二甲基标记定量,从2000多个背景蛋白中成功地筛选到了这些药物的已知靶蛋白,且靶蛋白都发生了显著性变化。在格尔德霉素模型中,成功地筛选到了已知的靶蛋白HSP90家族,并发现了潜在的脱靶蛋白PRDX家族。在泛激酶抑制剂星孢菌素模型中,从超过6000个蛋白的定量结果中,筛选到了40个有潜力的候选靶蛋白,其中有32个蛋白为已知的蛋白激酶。
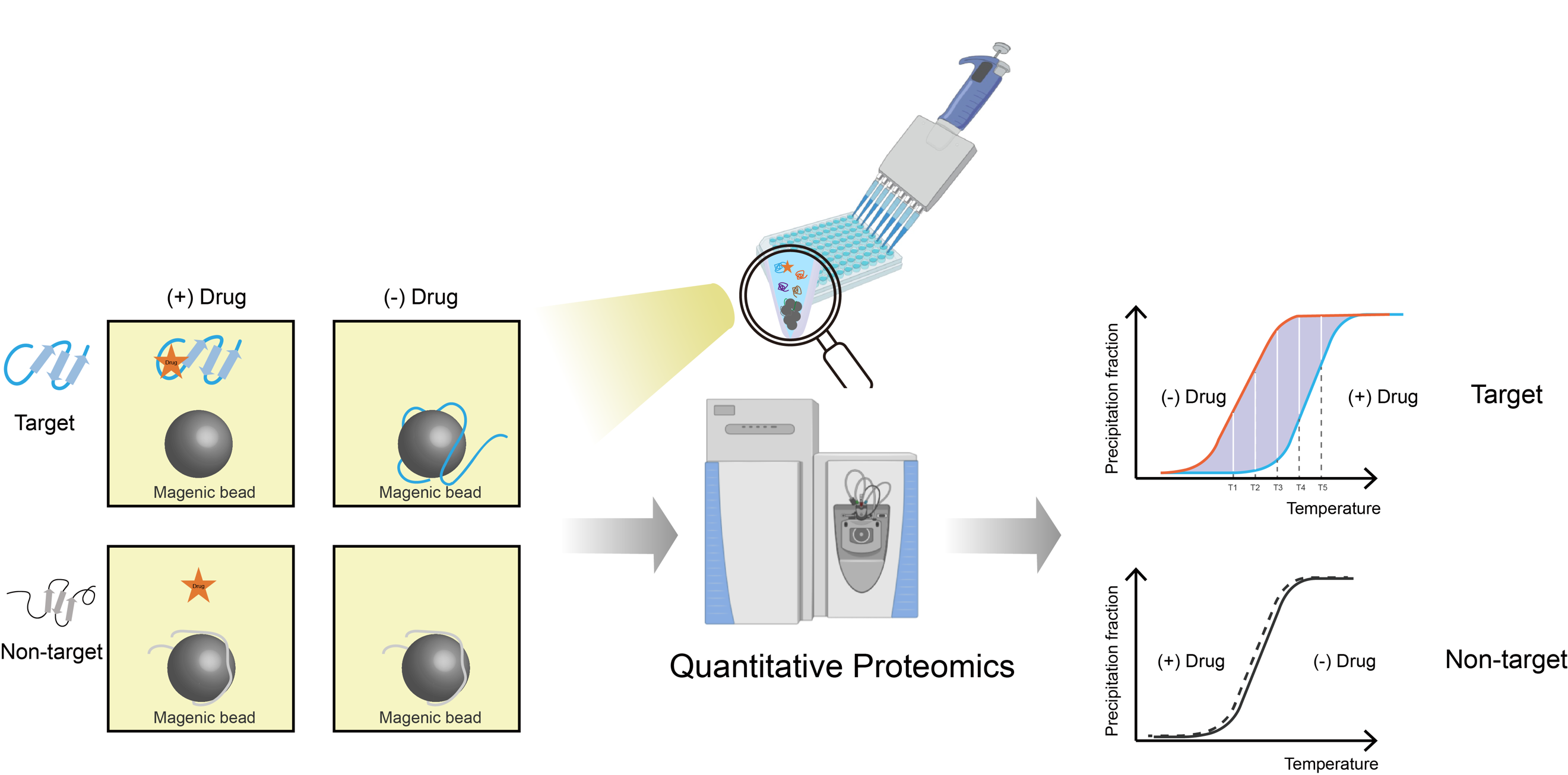
在本研究工作中,我们提出了一种新的药物靶点筛选方法,重点分析了蛋白在热致沉淀过程中的热稳定性变化。该方法对微量的生物样品非常友好,能从极低的起始量蛋白中成功地筛选到模型药物的已知靶蛋白;相比经典的TPP方法,MAPS方法更适合分析微量样品;此外,MAPS方法具有良好的可扩展性,易于自动化,样品制备过程快速可靠;结合高通量液体转移系统,MAPS方法能实现高通量的药物靶蛋白筛选。 (文/图 吕佳纹)