蛋白质糖基化的异常和癌变密切相关,因而被越来越多的应用于疾病病理生理学的探究和肿瘤生物标志物的发现等方面。目前,大多数被批准临床使用的肿瘤生物标志物为糖蛋白(如CEA、CA-125、PSA或AFP等)或糖抗原(如CA19-9等)。由于肿瘤细胞中糖苷酶和糖基转移酶的异常活性可能导致蛋白质特定位点上糖型的变化,因此,位点特异性糖型将是很有前景的生物标志物。目前,特定蛋白质上特定糖型的生物标志物仅有用于诊断肝癌的AFP-L3(带核心岩藻糖的甲胎蛋白)。在复杂生物体系自下而上的蛋白质组学研究中,糖基化肽段的丰度远低于其他多肽。因此,糖基化肽段的富集是提高检测灵敏度和可信度必不可少的实验流程。然而,糖基化蛋白质组学通常需要繁琐的实验步骤来进行完整糖肽的富集,使其难以应用于大规模临床样品的分析。近期,我组报道了一种自动化的完整糖肽富集方法。该方法实现了对血清位点特异性N-连接糖基化蛋白质组学的高重现性分析,并应用于研究胰腺癌患者血清中蛋白质N-连接糖基化的变化。相关成果以“Automated Intact Glycopeptide Enrichment Method Facilitating Highly Reproducible Analysis of Serum Site-Specific N-Glycoproteome”为题发表在国际化学权威杂志Analytical Chemistry(Anal. Chem. 2021, 93, 20, 7473–7480)上(DOI: 10.1021/acs.analchem. 1c00645)。
在本工作中,我们开发了一种自动化的完整糖肽富集方法,用于分析血清位点特异性N-连接糖型。该方法通过配置了亲水作用色谱柱(HILIC)的超高效液相色谱仪实现了每20分钟内即可对一份5微升血清酶解样品的N-连接糖基化肽段进行富集,通过微柱液相色谱-纳喷质谱联用技术(LC-MS/MS)实现了对1微升血清N-连接糖肽的分析,并从每1微升起始血清中鉴定到来自约130个糖蛋白的近1200条完整N-连接糖肽。与传统的利用手动SPE富集方法相比,该自动化方法具有更好的富集特异性(84% versus 36%)、更高的完整N-连接糖肽鉴定量(1198 versus 745)、和更优的糖肽定量重现性(CV值中位数9% versus 17%)。此外,我们通过批内/批间实验证明了本文方法在长时间运行中的高重现性;通过交叉污染实验证明了该方法的在连续进样中低残留的优势;并尝试将该方法应用于探究胰腺癌患者组和健康对照组之间血清位点特异性N-连接糖型的变化,通过定量完整糖肽的主成分分析实现了对两组样品的良好的聚类。通过对差异位点特异性N-连接糖型的分析,我们发现胰腺癌患者血清中糖蛋白IgG1的180位点上单岩藻糖且非唾液化的糖链的表达量显著低于健康对照组。总之,该自动化方法是复杂生物样本位点特异性N-糖基化蛋白组学分析的强有力工具,具有较好的临床应用潜力。
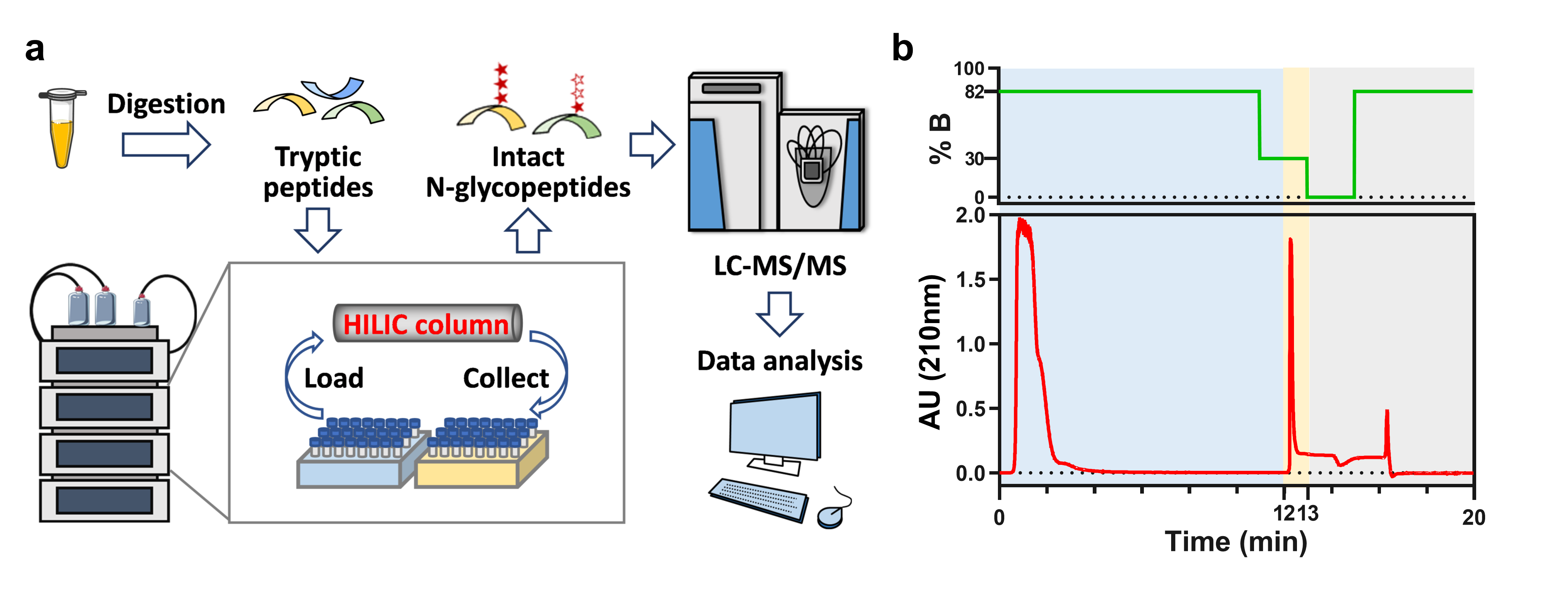
本研究工作发展了一种自动化完整糖肽富集方法,其富集特异性高、糖肽定量重现性好、适于长时间的运行和规模化的分析;能够用于微量复杂生物样品的糖基化蛋白质组学分析,并在新型疾病标志物的筛选方面有较好的应用前景。
该研究工作被科研公众号“分析人”进行了特别推送报道。https://mp.weixin.qq.com/s/oEmX8Z4009aGMOAxDTH2KQ (文/图 刘璐瑶)