蛋白质翻译后修饰(Protein post-translational modification, PTMs)是一种共价修饰,通常在特定的蛋白质位点上进行酶促修饰,增加蛋白质的功能多样性,影响细胞生物学过程的几乎所有方面。蛋白质的磷酸化和糖基化是生物体内两种重要的翻译后修饰,M6P糖基化修饰是在高甘露糖型糖链的甘露糖C-6位置上,发生磷酸化修饰的一种特殊修饰,它在转移溶酶体水解酶至溶酶体过程中发挥着关键作用,并参与其它的生物学过程。据报道,许多蛋白质可以携带多个PTMs,这意味着特定PTMs之间的调节存在交互作用的可能性。因此同时富集和分离来自同一生物样本的具有不同PTMs的酶解肽段,可以使不同PTMs之间的交互作用(cross-talk)研究成为可能,同时也可以减少样本消耗,避免复杂的样本处理过程。目前常用的PTMs交互作用分析策略一种称为不同翻译后修饰顺序富集(serial enrichments of different post-translational modifications, SEPTM)的方法,可以从同一生物样本中富集多个PTMs。然而,这个方法仍然存在需要使用不同的材料来进行肽段富集的问题。目前也有一些新的IMAC材料被开发出来,用于同时富集糖肽和磷酸肽,然而如果不对富集的肽段进行适当的分离,在正离子模式的液质联用分析中,带负电的唾液酸化糖肽信号会被更丰富的中性糖肽所抑制,而多磷酸肽和甘露糖-6-磷酸(M6P)糖肽也会被单磷酸肽所抑制。
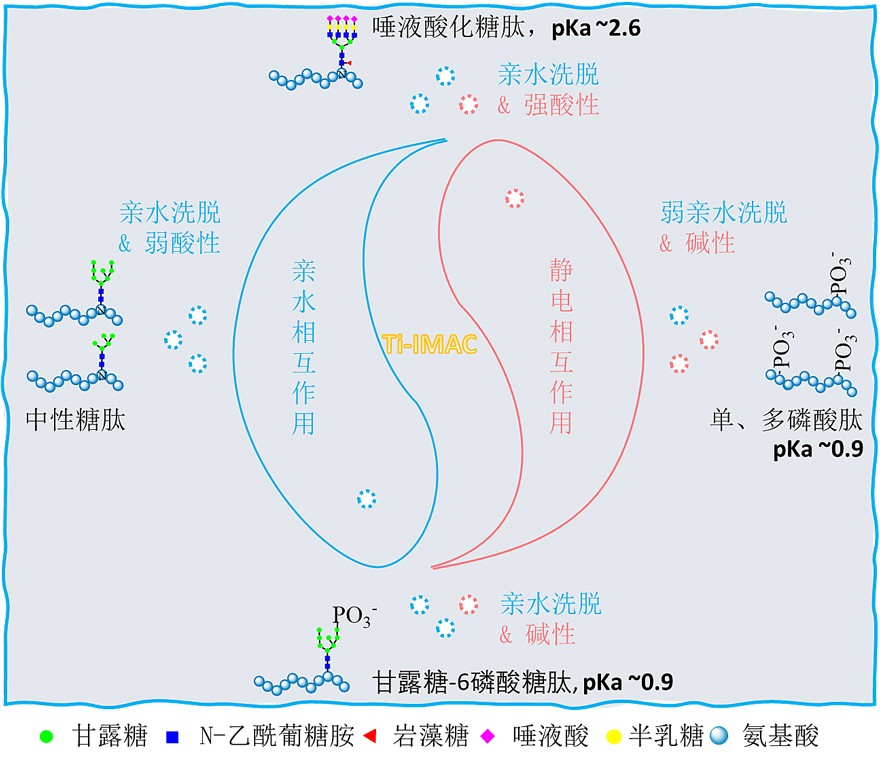
为了克服同时富集多种PTMs肽段在质谱分析中的相互干扰问题,威斯康星大学麦迪逊分校李灵军教授团队和中科院大连化学物理研究所叶明亮研究员团队率先使用双功能Ti-IMAC材料同时富集磷酸肽和M6P糖肽,并根据这两种肽段亲水性质的差异,在洗脱过程对它们进行分离,这种策略消除了磷酸肽对M6P糖肽的干扰,使其鉴定的特异性显著增加(Anal. Chem., 2019, 91, 11589-11597)。实现这一策略的基础是双功能的Ti(IV)-IMAC材料不仅具有大量的磷酸基团螯合的四价钛离子(Ti(IV)),可以通过静电相互作用富集磷酸肽,而且材料表面还含有大量的羟基、胺基和磷酸基等亲水基团,可以通过亲水相互作用富集糖肽。由于M6P糖肽同时具有磷酸肽和糖肽的理化特性,它可以通过协同的静电和亲水相互作用被双功能Ti(IV)-IMAC材料捕获,因此通过梯度洗脱,可以将其从磷酸肽中分离出来。然而,在这种策略中,糖肽在富集过程中与非磷酸肽一起被丢弃。

图片来源:Anal. Chem.
为了克服上述方法的不足,李灵军教授团队和叶明亮研究员团队对之前的策略进行了改进和优化,并不断探索Ti(IV)-IMAC材料的亲水性特性,使用传统的亲水相互作用色谱法的上样模式将样品加载到Ti(IV)-IMAC材料上,通过这种方式,中性糖肽通过亲水性相互作用被捕获到材料上,磷酸肽通过静电相互作用被捕获,而唾液酸化和M6P糖肽则通过静电和亲水性协同作用被捕获,使得双功能Ti(IV)-IMAC材料能同时富集糖肽、磷酸肽和M6P糖肽。富集与洗涤之后,根据不同类型糖肽与磷酸肽的静电或亲水性的差异,通过四步的洗脱:(一)弱酸性亲水洗脱;(二)强酸性亲水洗脱;(三)碱性弱亲水洗脱;(四)碱性强亲水洗脱,使它们的分离成为可能。在第一步的弱酸性亲水洗脱中,亲水相互作用被打破,使得中性糖肽率先被洗脱出来。唾液化糖肽则在第二步中被较多的洗脱,这是由于唾液酸的pKa值为2.1,因此唾液酸在第一步弱酸性洗脱液中不能质子化,仍能通过静电相互作用被Ti(IV)-IMAC材料捕获,而在第二步强酸性洗脱液中,唾液酸可以被质子化从而被洗脱。值得一提的是,在强酸条件下并没有洗脱太多的磷酸肽和M6P糖肽,这是因为磷酸基团的pKa值为0.7-1.0,远低于唾液酸,难以被质子化,从而仍被保留在材料上。这些结果表明,双功能Ti(IV)-IMAC材料不仅能高效地富集糖肽,而且还能从中性糖肽中分离出唾液酸化糖肽。由于唾液烷基化在各种生物过程中有着广泛的应用。因此,全面的分析唾液酸化糖肽将有助于阐明它们在相关生物过程中的作用,并有助于发现新的疾病生物标志物和药物靶点。
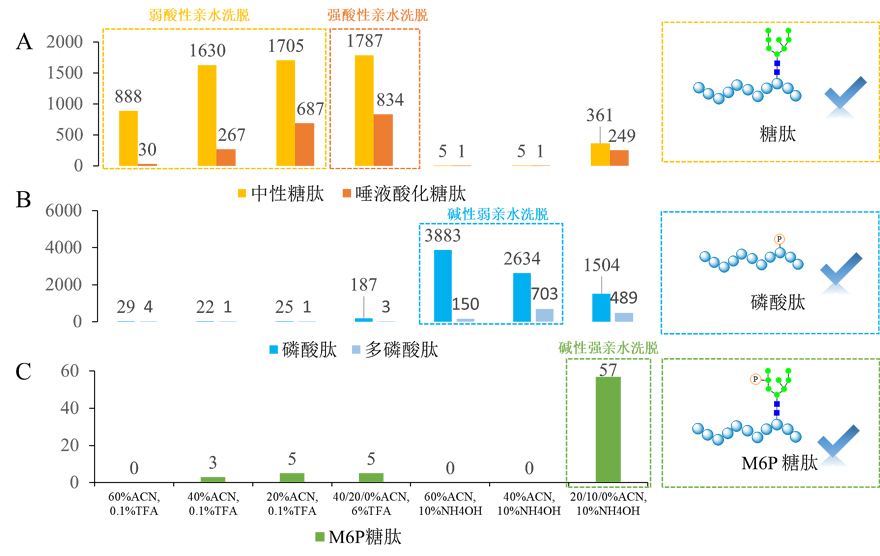
在第三步的碱性弱亲水洗脱中,静电相互作用由于碱性的条件被打破,大部分单磷酸肽和多磷酸肽被洗脱,而且多磷酸肽比单磷酸肽亲水性更强,通常单磷酸肽先被洗脱,而后随着亲水洗脱条件加强,多磷酸肽逐渐被洗脱,这些结果表明,双功能Ti(IV)-IMAC材料不仅可以高效有效地富集磷酸肽,而且可以根据亲水性的差异将多磷酸肽与单磷酸肽分离,对单和多磷酸肽的全面分离和表征对于理解磷酸化信号的分级调控具有重要意义,可以帮助研究者更精确地理解调控信号转导通路的开关。在第三步洗脱中,虽然静电相互作用被打破,然而仍然是弱亲水的洗脱条件,M6P糖肽由于比磷酸肽具有更强的亲水性,而仍然被保留在Ti(IV)-IMAC材料上。只有通过第四步的碱性强亲水洗脱,亲水和静电相互作用同时被打破,才能有效地洗脱M6P糖肽。
因此,通过这些分离洗脱步骤,有效地消除了中性糖肽对唾液酸化糖肽、单磷酸肽对多磷酸肽,以及上述几种修饰肽段对M6P糖肽的信号检测抑制作用,使这几种修饰肽段的鉴定量都能得到明显的提升。该方法从500微克小鼠肺组织中鉴定到3896个糖肽、5539个磷酸肽和65个M6P糖肽,与传统方法相比将糖肽、磷酸肽和M6P糖肽的鉴定数量分别提高了1.9倍、2.3倍和4.3倍。这是首次报道的通过双功能Ti(IV)- IMAC材料同时富集和分离中性和唾液酸化糖肽、单磷酸和多磷酸肽以及M6P糖肽,为揭示这些重要的PTMs之间潜在的交互作用奠定了基础。

这一成果近期发表在Analytical Chemistry 上,文章的第一作者是威斯康星大学麦迪逊分校博士后黄俊峰,共同通讯作者为中科院大连化学物理研究所叶明亮研究员和威斯康星大学麦迪逊分校李灵军教授。