O-乙酰葡糖胺(O-GlcNAc)修饰发生在丝氨酸/苏氨酸(Ser/Thr)残基上,是生物体内最重要的蛋白质翻译后修饰(PTM)之一,其与磷酸化修饰存在密切相互作用,参与细胞代谢、信号转导、免疫应答等生理过程。然而,O-GlcNAc丰度低,并且处于高度动态变化,极大的增加了其富集与分析的难度。目前报道的富集方法主要包括以下两种策略:1)基于凝集素法、抗体法等非共价结合的富集方法,其亲和力偏弱,易发生非特异性吸附;2)共价键结合富集,以高碘酸钠(NaIO4)直接氧化O-GlcNAc,由于其中存在的是反式邻二醇羟基,导致氧化收率较低,难以富集(图一A)。基于化学酶促标记或非天然糖代谢标记的策略通过引入生物正交反应基团显著提高了富集特异性,然而容易引入大质量的标签,进而影响糖肽的鉴定效率。伍荣护等人通过向O-GlcNAc中引入半乳糖(Gal)基团,利用半乳糖氧化酶(GAO)引入醛基,进而用酰肼材料捕捉释放的方法,实现了O-GlcNAc糖肽的富集(图一B)。该方法一定程度上易受GAO酶活性、副反应等因素影响。近期,我组报道了一种兼具高效率和通用性的O-GlcNAc糖肽富集鉴定新方法,称为CHO-GlcNAc,首先通过酶促反应将Gal基团转移到O-GlcNAc上,然后利用NaIO4将Gal氧化,进一步利用可逆酰肼化学法进行捕捉与释放实现O-GlcNAc糖肽的高效富集(如图一C)。相关成果以“Highly Efficient Enrichment of O-GlcNAc Glycopeptides based on Chemical Oxidation and Reversible Hydrazide Chemistry”为题发表在国际化学杂志Analytical Chemistry上(DOI: 10.1021/acs.analchem.1c04031)。
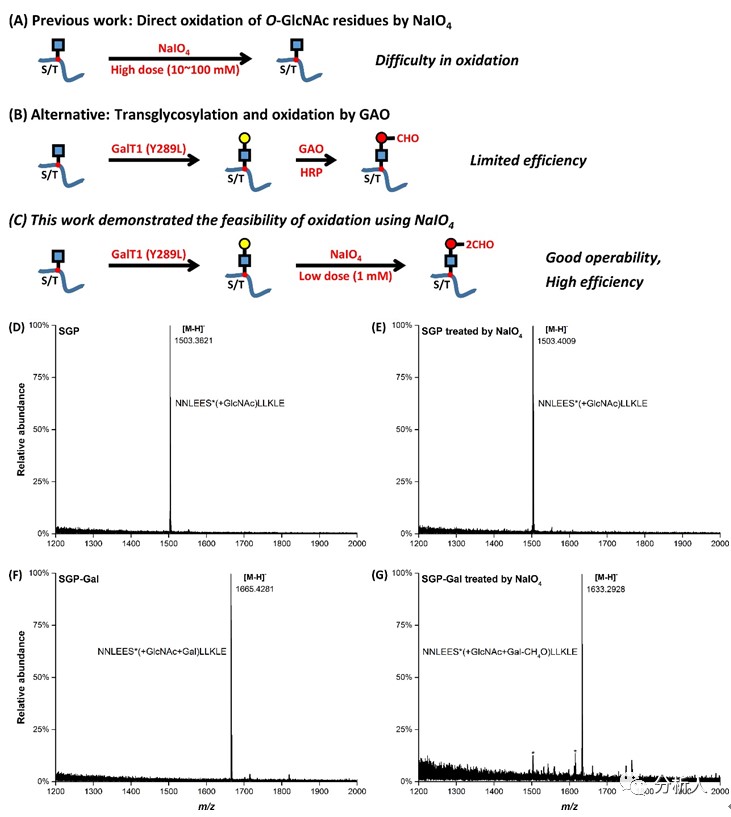
图一 本文实验原理与已有方法的对比和可行性验证
如图二A,我们首先利用半乳糖转移酶突变体Gal-T1 Y289L在O-GlcNAc糖肽上引入Gal基团,随后用NaIO4氧化Gal产生两分子醛基,以酰肼树脂共价捕捉后洗净非特异性吸附肽段,通过甲氧胺(CH3ONH2)溶液释放使糖肽的O-GlcNAc基团添加总计+188 Da的标记,提升质谱鉴定的效率和特异性。由于肽段N-端的Ser/Thr也会发生氧化,我们通过二甲基封闭有效避免了此副反应的发生。该方法于37℃下以1 mM浓度的NaIO4反应2.5 h即可实现标记Gal基团糖肽的完全氧化,具有良好的特异性与技术重现性(如图二B-E),并通过捕捉释放产物MS2谱图中m/z=204.08 Da(对应O-GlcNAc基团)和392.15 Da(对应带有Gal氧化释放标记的O-GlcNAc)的碎片峰确认鉴定结果的可靠性,同时根据此m/z差值识别未脱落糖基和标记的肽段碎片离子对,实现对修饰位点的精确定位(如图二F-H红框所示)。

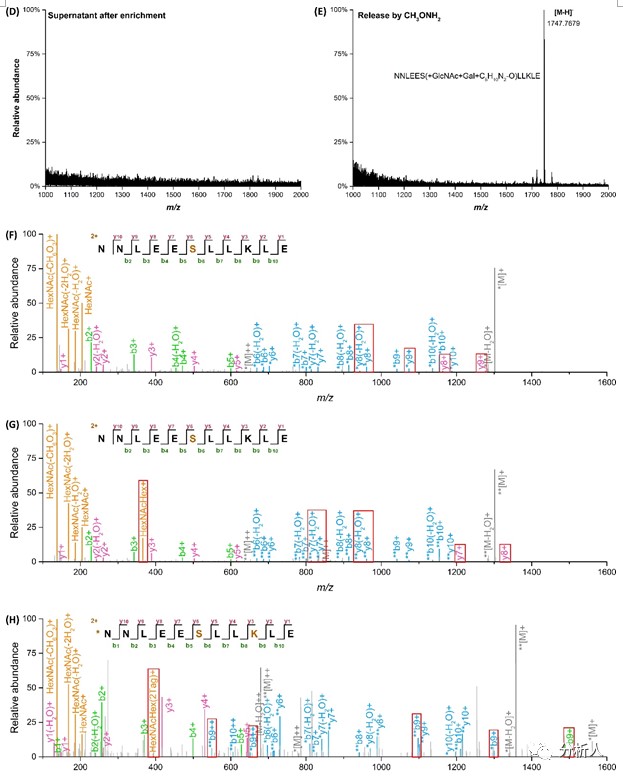
图二 本文技术路线应用于标准O-GlcNAc肽及所得转糖释放产物的MS2谱图
将该方法应用于HeLa细胞核蛋白O-GlcNAc糖基化分析,从300 μg起始样品中可以鉴定到非冗余O-GlcNAc糖肽(228条、228条和231条)、潜在位点数目(194、189和182)以及对应糖蛋白(92个、83个和84个)。该方法具有良好重现性与通用性(如图三A),三次技术重复共鉴定到的303处独特潜在O-GlcNAc位点和106种糖蛋白中分别有166个(约60%)和84个(约80%)可被2次以上的平行实验检出(如图三B),并通过前述MS2谱图中带有特征性糖基标记的肽段碎片离子实现了多个修饰位点的精确定位(见图三C-D红框)。
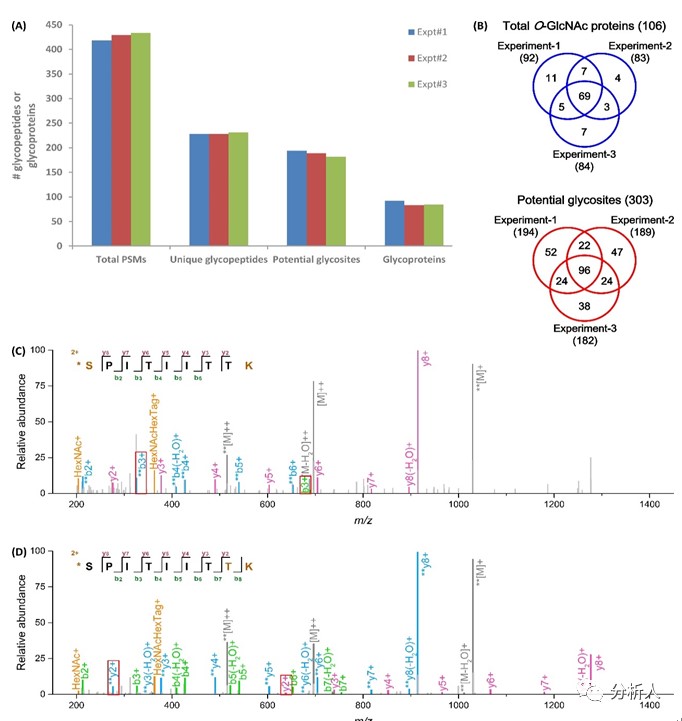
图三 CHO-GlcNAc方法富集HeLa细胞核O-GlcNAc糖肽的3次技术重复
用CHO-GlcNAc方法处理1.8 mg HeLa细胞核蛋白样品,对释放产物进行预分级以进一步提升对细胞核蛋白O-GlcNAc的鉴定深度,从中检出来自262种蛋白质的814条独特O-GlcNAc糖肽;与前述3组平行实验数据合并,共得到829处潜在O-GlcNAc修饰位点,其中530个位点(约2/3)被1985-2020年的人类O-GlcNAc蛋白质数据总集覆盖(另299处未被覆盖),而其中仅有1/3(296/829)位点在Hela细胞中鉴定(如图四A)。上述数据中有61处位点与磷酸化数据重合(如图四E),提示O-GlcNAc与磷酸化修饰可能存在竞争作用机制。本文鉴定的274种O-GlcNAc糖蛋白主要位于细胞核基质,功能主要集中于转运和处理RNA,约有1/4属于低拷贝数的转录因子(如图四B、D);其中多达15.7%含有5处以上O-GlcNAc修饰(如图四C)。上述O-GlcNAc糖蛋白中包括识别RNA上N6-甲基腺苷(m6A)的YTH蛋白家族成员YTHDF1、YTHDF3,以及组蛋白H3K9去甲基化酶KDM3B,它们均匹配到不止一处潜在O-GlcNAc修饰(包括YTHDF1的Ser198和KDM3B的Ser647两处磷酸化阴-阳位点,如图四F),且均含有通过未脱落糖基和特异性标记的肽段碎片确定的修饰位点(YTHDF1的Ser196、YTHDF3的Thr205、KDM3B的Ser668,如图四G-H),从而提供了O-GlcNAc与磷酸化、甲基化等修饰相互作用的论据。
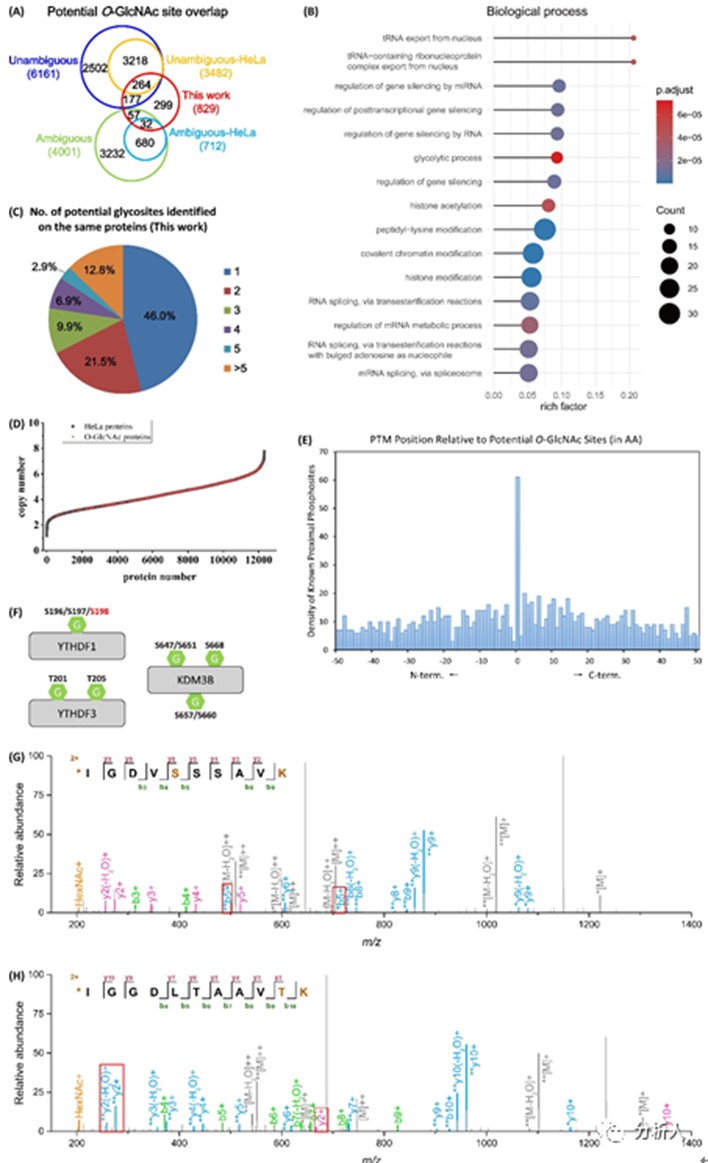
图四CHO-GlcNAc方法鉴定细胞核O-GlcNAc糖蛋白合集数据分析
我们基于化学酶促标记、化学氧化与可逆酰肼化学反应,发展了名为CHO-GlcNAc的糖肽富集方法,其操作简便、富集特异性强、鉴定效率高,适用于存在大量高丰度非糖肽的复杂生物样品,为O-GlcNAc蛋白质组学分析提供了实用的工具。该工作获国家自然科学基金、国家重点研发计划、大连化物所创新基金等的资助。该研究工作被科研公众号“分析人”进行了特别推送报道。https://mp.weixin.qq.com/s/K6cIcNj8JClx7-7jLs5Znw (文/图 陈尧)