药物-靶蛋白相互作用的研究促进了新药开发、生物标志物发现,有助于我们更深入地理解疾病相关分子机制、细胞信号转导等与人类健康息息相关的生物学问题。热蛋白质组学分析(Thermal Proteome Profiling, TPP)是目前研究药物-蛋白相互作用最为有力的工具之一,其重要优势在于无需对目标药物小分子进行繁琐的化学衍生。然而,经典的TPP方法仅仅对热处理后的可溶性组分进行定量蛋白质组学分析而忽略了同样包含重要信息的沉淀组分。TPP采用“S”形熔解曲线拟合的算法进行热蛋白质组的数据处理,而曲线拟合的过程中部分拟合不佳的蛋白质的信息会被滤去。这些因素无疑都增加了丢失重要药物-蛋白互作信息的可能性,并影响着该方法的检测灵敏度。为了解决上述问题,在本工作中,我们提出了一种沉淀组分支持的热蛋白质组学分析 (Precipitate-Supported Thermal Proteome Profiling, PSTPP) 方法用于药物靶标蛋白的全面筛选与鉴定。与传统方法相比,PSTPP方法的靶蛋白鉴定的灵敏度和通量均有了较大的提高。相关成果以“Precipitate supported thermal proteome profiling coupled with deep learning for comprehensive screening of drug target proteins”为题发表在国际化学权威杂志ACS Chemical Biology(2022 Jan 21;17(1):252-262. doi: 10.1021/acschembio.1c00936.)上。
在PSTPP方法中,我们首次利用了热处理后获得的上清组分和沉淀组分的互补信息来提高靶蛋白鉴定的灵敏度和特异性。同时为了避免“S”形曲线拟合过程会遗漏重要潜在靶蛋白的问题,我们开发了一个基于图像识别的机器学习算法对蛋白质的熔化曲线进行识别。这两点变化极大地提高了药物分子靶蛋白鉴定的灵敏度。在使用一些模式药物(包括甲氨蝶呤、雷替曲塞、SNS032)进行方法学标准化中,我们成功地鉴定到了这些药物的已知靶蛋白以及一些潜在的靶蛋白。随后,在泛激酶抑制剂星孢菌素模型中,从超过6000个蛋白的定量结果中,筛选到了119个有潜力的候选靶蛋白,其中有99个蛋白为已知的蛋白激酶。该激酶靶标的鉴定数目是经典TPP方法鉴定数目的2倍左右,说明我们所开发的PSTPP方法的鉴定灵敏度有了极大的提高。最后,我们将PSTPP方法运用到“神药”雷帕霉素的靶蛋白的鉴定中,并且成功地鉴定到了雷帕霉素的已知靶蛋白FKBP1A以及同家族的另外两个蛋白,FKBP2和FKBP3。
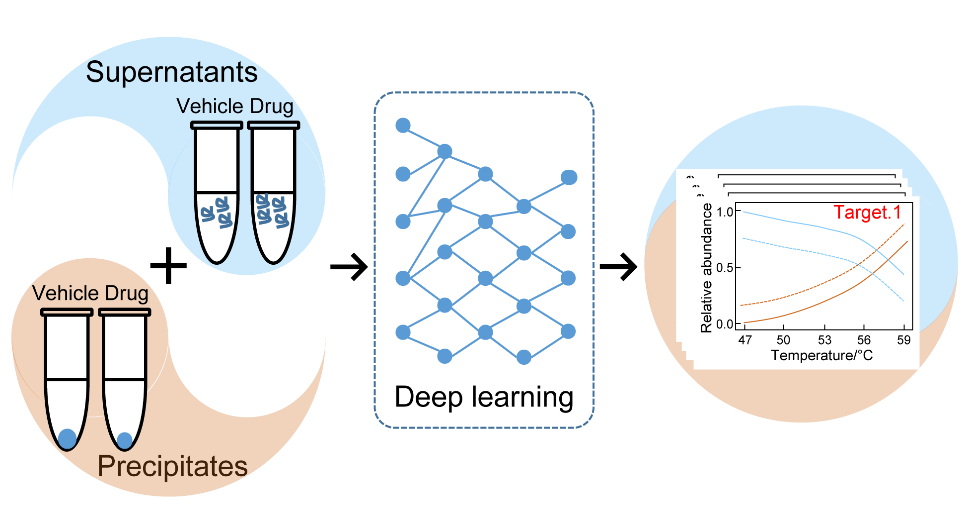
在本研究工作中,我们提出了一种新的基于热蛋白质组分析的药物靶点筛选方法。与经典方法比较,该方法具有更高的靶蛋白鉴定的灵敏度和通量,为未来更多药物分子靶标蛋白的全面鉴定提供了一种新的思路。该工作被“ACS美国化学会”公众号进行了特别推送报道(https://mp.weixin.qq.com/s/M-5DQYNyJmOA8wIowXPxiQ)。 (文/图 阮成飞)