紫草是一种重要的中草药,已经使用2000年多。经典的萘醌天然产物紫草素(SHK) 是紫草的生物活性成分,具有多种生理和药理特性,包括抗炎、伤口愈合和抗癌作用。最近的研究表明,SHK具有显著的抗肿瘤活性,如诱导细胞周期停滞和凋亡,抑制各类癌细胞的增殖。SHK的抗肿瘤机制是由Bcl-2家族蛋白和NF-κB通路介导的。然而,其对结肠癌作用的潜在机制尚未确定。
2022年3月9日,大连医科大学马骁驰,中国科学院上海药物研究所果德安及我组组长叶明亮研究员以共同通讯作者在靶向药物领域权威期刊Signal Transduction and Targeted Therapy (IF=18)在线发表题为“Characterization of a small-molecule inhibitor targeting NEMO/IKKβ to suppress colorectal cancer growth”的研究论文,该研究使用分子药理学表型分析、蛋白质组学和生物信息学分析的组合策略,将紫草素 (SHK) 确定为 IKKβ/NEMO 复合物的潜在抑制剂。(Signal Transduction and Targeted Therapy, 2022, 7, 71; https://doi.org/10.1038/s41392-022-00888-1)
为了探究SHK抑制结直肠癌进展的机制,我组博士后张晓磊(本文共同一作)采用热蛋白质组分析(TPP)和我们组此前发展的溶剂诱导蛋白沉淀方法(SIP)鉴定SHK的靶标蛋白。这两种方法是基于与SHK结合的靶标蛋白对温度或溶剂引起蛋白沉淀速率产生变化的原理,即化合物结合蛋白和未结合蛋白在通过加热或溶剂变性时可以产生差异沉淀,从而通过基于质谱的定量蛋白质组学技术捕捉蛋白丰度差异进而确定SHK结合蛋白(图1A)。在本研究中,TPP 和 SIP 方法共同定量到2269个蛋白(图1B)。在 TPP 和 SIP 数据集中采用-log10 P ≥ 3.5的阈值后,获得22个由SHK引起显著变化的蛋白质(图1C)。因为在加热和溶剂处理中都观察到稳定性变化,所以这些蛋白是结肠直肠癌细胞中SHK的候选靶标。体外和体内实验表明,SHK可以通过抑制炎症通路来抑制结直肠癌的进展。在对22种候选蛋白质进行GO生物过程分析后,在“炎症反应”的炎症相关功能簇中鉴定到NEMO蛋白(图1D)。在基于质谱分析的基础上,进一步我们利用加热和溶剂处理对照组和SHK组,并结合蛋白质印迹技术对SHK处理前后NEMO蛋白产生的稳定性变化进行分析。结果表明,在两种变性方法中,SHK处理后加速了NEMO蛋白对温度或溶剂引起的沉淀(图1E和F,中间两条带),表明NEMO可能与SHK有直接相互作用。众所周知,NEMO和IKKβ是IKK复合体的亚基,因此,SHK有可能也会改变IKKβ稳定性的变化。正如预期的那样,根据蛋白质印迹分析,我们发现IKKβ可能与SHK直接相互作用(图1E和F,前两个条带)。这些结果表明NEMO/IKKB复合物将是SHK下调NF-κB途径的潜在靶标。
该研究在蛋白质组学的基础上,又结合分子药理学表型分析和生物信息学分析策略明确地将NEMO/IKKβ复合物鉴定为SHK的抗肿瘤靶点的研究。SHK被发现是迄今为止报道的最有效的NEMO/IKKβ复合物小分子PPI抑制剂(IC50-170 nM)。它有效地阻止了体外、细胞培养甚至动物模型中的复合物形成,逆转了许多结肠癌细胞表型,例如增殖、迁移和侵袭性。综上所述,这些结果揭示了SHK的抗肿瘤机制,并提供了对NEMO/IKKβ复合物功能的深入理解,所有这些都为开发有效的 NEMO/IKKβ小分子PPI抑制剂提供了有用的指导。该工作被iNature前沿报导为一个重要突破(https://www.163.com/dy/article/H2EQLN3L05329KGN.html)。
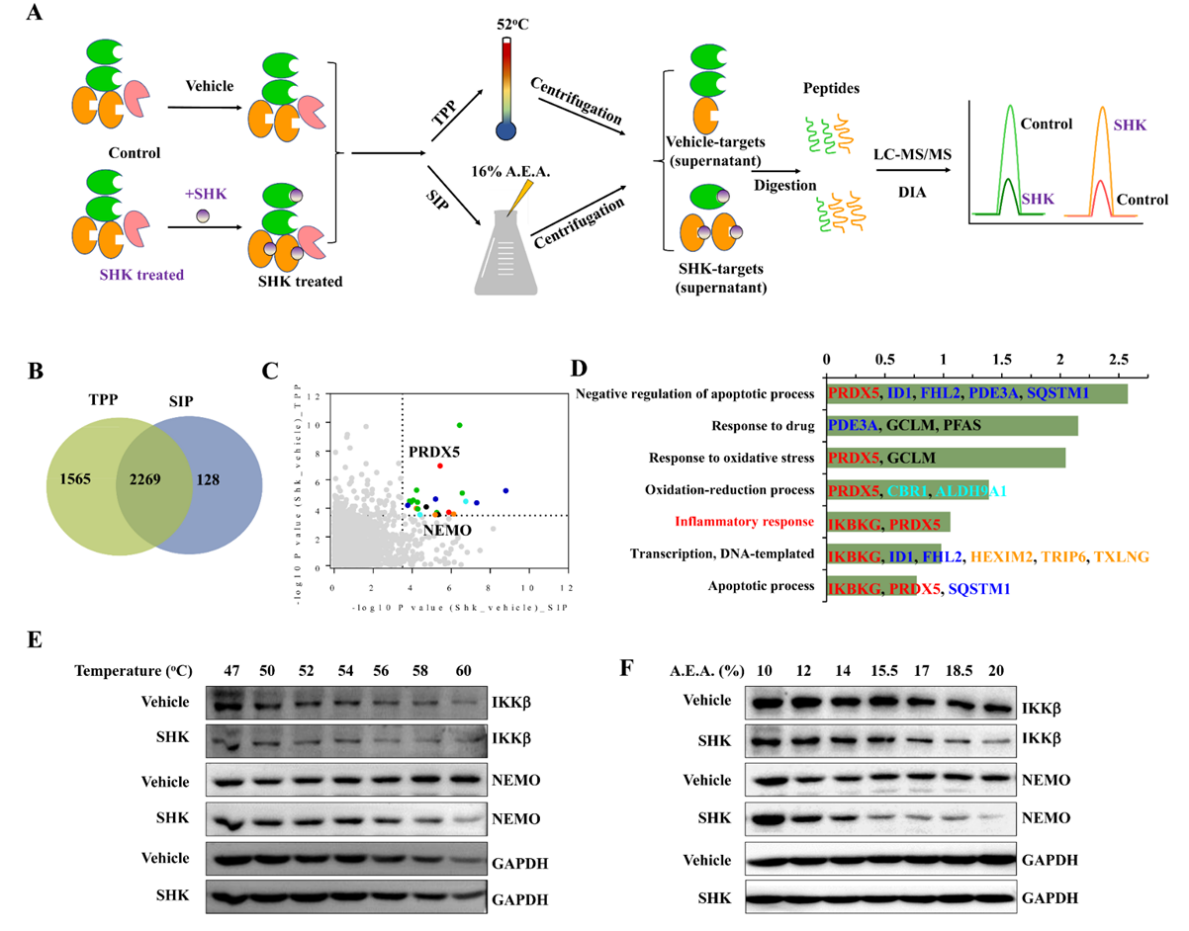
图1 TPP和SIP方法鉴定IKGKG(NEMO)为紫草素抗炎抗肿瘤的靶点
溶剂诱导蛋白沉淀方法(SIP) 是我组在2020年发展起来的一种利用药物结合蛋白相对于药物未结合蛋白具有更高的稳定性,对溶剂引起的蛋白变性沉淀具有更高的耐受性从而捕捉药物靶标蛋白的方法(Analytical Chemistry, 2020, 92, 1363; doi: 10.1021/acs.analchem.9b04531)。该方法特异性高,通量高,操作简单,克服了传统基于药物修饰的化学蛋白质组学方法需要对配体进行修饰的难题,以及基于非修饰药物的热变性方法难以实现部分靶蛋白质对热不敏感的问题,是目前唯一能与热变性方法媲美的方法。哈佛医学院Gygi团队验证了SIP方法的稳健性和互补性,并将SIP与TMT标记试剂结合后发展了SPP方法(eLife, 2021, 10, 70784)。我们受邀为 Springer Nature 的《分子生物学方法》书籍撰写SIP方法的具体流程。SIP方法具有自主知识产权,已经申请中国专利(专利号:201911140968.3)和国际PCT专利(专利号:PCT/CN2020/130079)。综上,SIP方法能够为药物或其他小分子的靶标蛋白筛选提供有力的平台。(文/图 张晓磊)