近日,我组开发了表征蛋白质中组氨酸残基反应活性的蛋白质组学分析新方法。该工作筛选并获得了具有组氨酸优异反应效率的α, β-不饱和醛探针,发展了基于烯醛探针的组氨酸标记技术和可逆酰肼化学富集方法,通过蛋白质组定量技术实现了人类蛋白质组中的组氨酸反应活性的高效表征。
氨基酸亲核反应活性的表征推动了共价药物靶点和候选药物分子的发现。组氨酸占据超过1/5人源酶活性中心,在生理环境中既是质子的供体又是质子的受体,受到蛋白质空间微环境的精细调控。然而,由于缺乏可以在生理条件下标记组氨酸的化学探针,在此之前尚难以实现组氨酸活性的全局性表征。
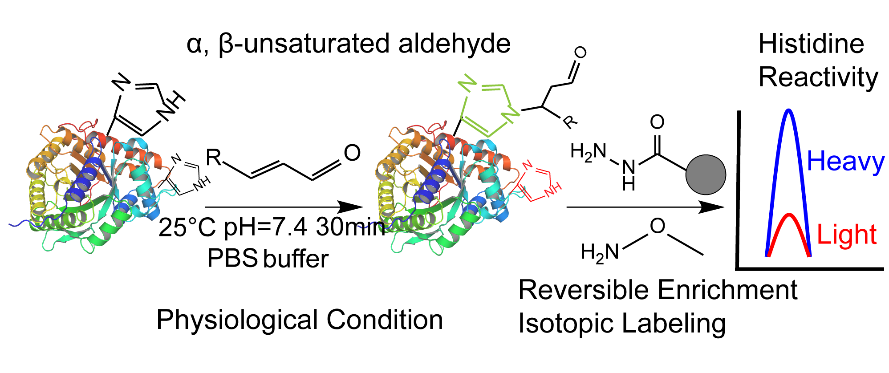
本工作发现α, β-不饱和醛在生理状态下即可与组氨酸残基发生迈克尔加成反应,且引入的醛基可作为富集标签用于后续的可逆酰肼富集。与基于点击化学的经典活性蛋白质组分析方法(ABPP)相比,该策略引入活性最高的烯醛探针—丙烯醛作为反应基团和富集标签,是目前报道的最小尺寸的ABPP多功能探针。同时,该方法样品处理流程简便,引入标签质量小,并通过可逆富集过程引入稳定同位素标记试剂,有效避免了传统工作中制备同位素连接臂的繁琐流程和高成本。该方法共定量了超过8200个组氨酸残基的标记效率,筛选到317个高亲核反应性组氨酸残基,并且发现组氨酸的反应活性和其磷酸化呈负相关。该方法为后续基于组氨酸的共价靶向偶联药物的开发提供了数据支持,且丙烯醛衍生物也可作为新型反应基团用于共价抑制剂的研制。
相关研究成果以“An ACR-Based Probe for the Quantitative Profiling of Histidine Reactivity in the Human Proteome”为题,于近日发表在《美国化学会志》(Journal of the American Chemical Society,https://pubs.acs.org/doi/10.1021/jacs.2c12653)。该工作的共同第一作者是我所与沈阳化工大学联合培养的硕士研究生李佳颖和我所博士研究生周家华。上述工作得到国家重点研发计划、国家自然科学基金、我所创新基金等项目的支持。(文/图 秦洪强、李佳颖)