1/ PELSA技术介绍
配体靶蛋白质的发现,是解析生命活动内在调控机制、推动医药创新、保障人类健康与生态安全的基础。由于蛋白质并非均一的整体,大多数配体与蛋白的结合仅发生在蛋白质的局部区域。鉴定配体结合区域能够直接为药物研发提供可供结合的位点,同时为深入研究药物-蛋白构效关系提供重要指导。我们课题组在配体免修饰靶点筛选方法开发方面先行一步,根据配体结合会导致蛋白质结合区域稳定性的改变进而影响酶切效率的原理,成功研发了目前具有最高灵敏度的配体免修饰靶蛋白质鉴定技术——以肽段为中心的蛋白局部稳定性探测技术(PEptide-centric Local Stability Assay, PELSA),该技术能实现从复杂体系中鉴定配体的靶蛋白质、结合区域以及测定亲和力,成功推动我国在配体与蛋白互作分析领域实现从技术跟随到引领的跨越式发展(Nature Methods, 2025, 22: 278-282)。PELSA具有完全的自主知识产权,其中中国专利已获授权(专利号:ZL202211030145.7),美国(申请号:18/699,403)、欧洲(申请号:23,856,231.8)、澳大利亚(申请号:2,023,328,841)、加拿大(申请号:3,266,000)、日本(申请号:P293234)、新加坡(申请号:11202501300V)、中国香港(申请号:62,025,107,477.4)等国家和地区的专利已处于审查中。更多详情请关注微信公众号“PELSA靶标分析”。

公众号代表性文章:
1、《从Cell到Nature Methods:小分子结合蛋白质鉴定技术PELSA的艰辛发表历程》
2、《PELSA-Decipher:PELSA靶蛋白质鉴定方法的专用数据处理软件发布》
3、《PELSA:基于结构微区稳定性变化,助力配体靶标蛋白的发现》
2/ PELSA技术原理
PELSA方法的原理是,靶蛋白质在结合配体后,结合区域的能量降低,稳定性提高,该区域的氨基酸序列“刚性”增加,从而变得不容易活动而较难进入蛋白酶的活性口袋(图1)。为了使处于低能量区的序列也能酶切,使用高酶浓度(E/S=1:2);为了使产生的肽段更容易被蛋白质组分析,PELSA使用胰蛋白酶(Trypsin)。在高的蛋白酶浓度下,蛋白首先被切为较大的亚基,由于酶切是一个破坏性过程,处于高能量状态或无配体结合的该亚基的结构迅速展开,诱导自身进一步酶切,最终产生拥有两个能反映蛋白区域稳定性酶切位点的、适合自下而上质谱分析的小肽段。而处于低能量状态或有配体结合的该蛋白区域仍然维持稳定结构,较难进入蛋白酶的活性口袋,因此该区域不容易产生小肽段。通过比较此类肽段丰度差异来确定能量状态有差异的蛋白;分析差异肽段在蛋白上的位置,能够确定能量状态有差异的蛋白区域,也就是配体的结合区。
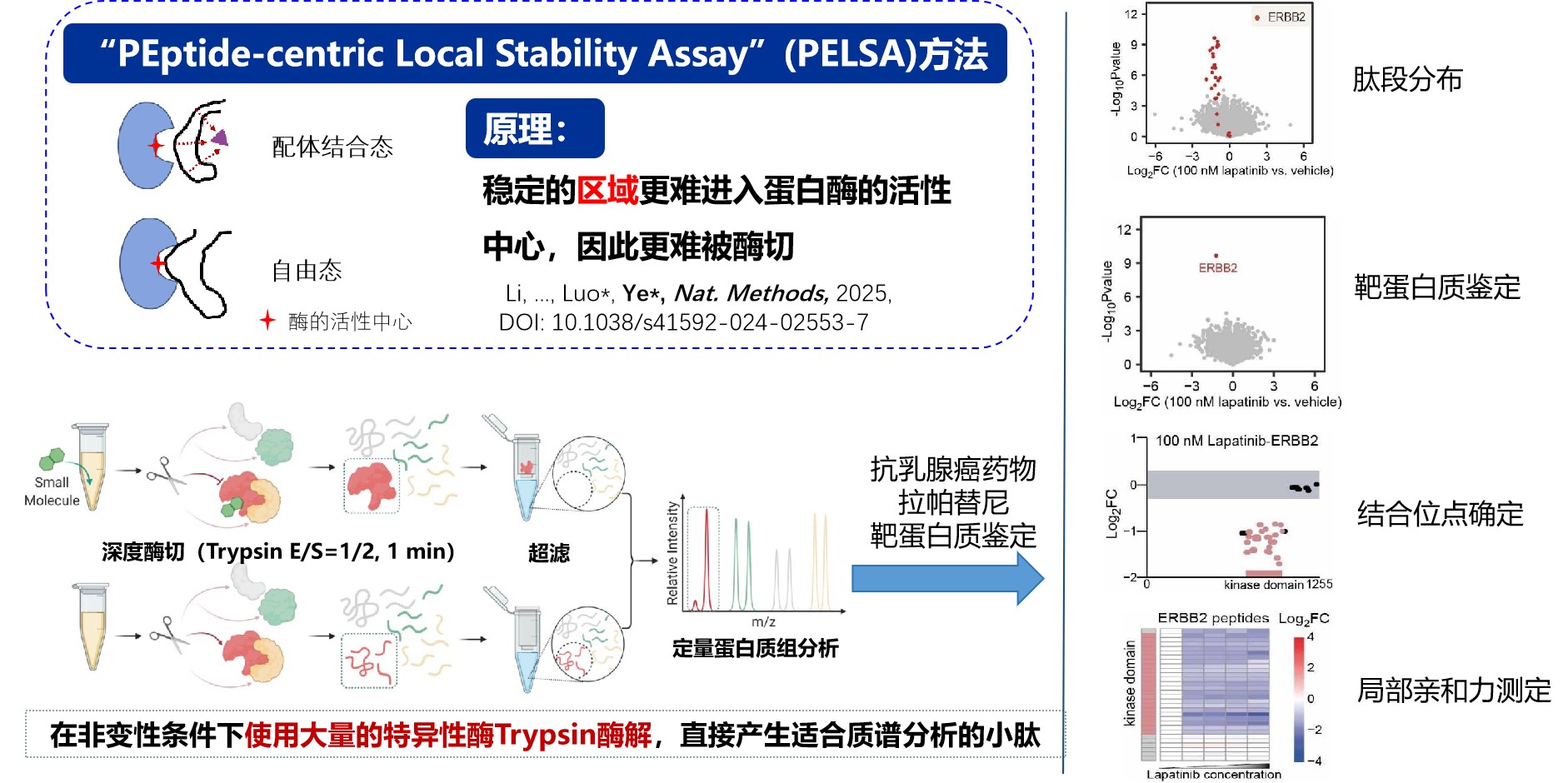
图1. PELSA技术能实现从复杂体系中鉴定配体的靶蛋白质、结合区域以及测定局部亲和力
我们课题组在最近发表的一个综述文章中(Curr. Opin. Chem. Biol.,2025, 87:102602)系统介绍了各种配体免修饰方法的优缺点。这里重点介绍一下,PELSA与LiP-MS都是限制性酶切技术,为什么PELSA灵敏度比LiP-MS高一个数量级。实际上两个方法的设计思路是不一样的,LiP-MS主要从构象的变化来设计方法,而PELSA主要从局部稳定性这一热力学性质的变化进行设计。LiP-MS将天然蛋白质通过非特异性蛋白酶轻微酶切生成结构特异性蛋白质片段,再经胰蛋白酶完全酶切以适用于高通量自下而上的蛋白质组分析。由于这类方法仅在第一步酶切中生成带有酶切位点的肽段反映配体诱导的局部结构变化,具有结构信息的肽段识别效率非常低,因此LiP-MS灵敏度非常低。PELSA的高灵敏度可能归因于多种原因。首先,胰蛋白酶肽段非常适合鸟枪法蛋白质组分析;同时,高酶/底物比(E/S=1:2)能够产生大量配体结合响应肽段;更重要的是其特殊放大机制。天然蛋白质的肽段生成过程可被概念化为连续性多阶段蛋白酶解级联反应(图2)。初始胰蛋白酶介导的酶解事件通常优先发生于蛋白质的柔性构象区域,因其具备更高的酶活性位点可及性。配体结合稳定柔性区域,通过空间位阻限制肽键与酶活性中心的接触,继而延缓初始酶解进程。在初始阶段,含赖氨酸(K)或精氨酸(R)残基的柔性片段首先被切割,引发蛋白质局部结构去折叠,继而暴露隐藏的K/R酶切位点,驱动级联酶解反应;而配体结合态蛋白质因构象稳定性增强,其酶解动力学显著滞后于非结合态,该延迟效应持续至配体-蛋白质复合物解离。结合态与非结合态的肽段丰度差异源于多阶段酶解速率差异的累积效应,该机制通过级联放大效应赋予PELSA技术高灵敏度识别结合蛋白和作用区域的能力。
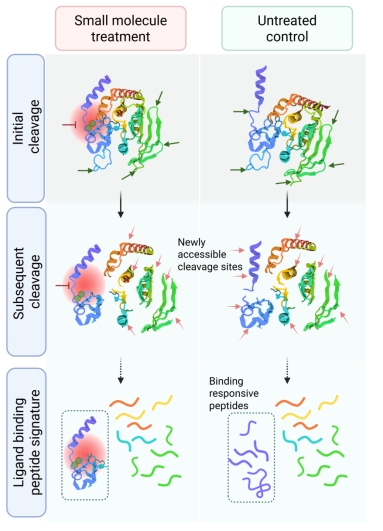
图2. PELSA策略的大量胰蛋白酶酶解机制-连续性多阶段蛋白酶解级联反应
3/ PELSA特色
一、不需要对配体进行化学修饰,提高数据真实性,降低鉴定结果的假阳性;另外对于不能进行化学修饰小分子结合蛋白的鉴定十分友好;
二、通过检测蛋白质丰度和结构变化两个维度信息,可同时获得配体结合蛋白和结合位点信息,具有高特异性和高灵敏度特点。如果加入药物浓度维度,还能够同时获得局部亲和力信息;
三、样品复杂度低,能够鉴定到大量包含配体结合信息的肽段。显著放大蛋白对配体结合的响应,具有极高的灵敏度;
四、通过结合基于DIA(数据非依赖采集)的质谱定量技术,具有高通量,高分辨率和高覆盖率的特点;
五、非常适合弱相互作用的系统鉴定,如代谢物靶蛋白质的鉴定;
六、能够广泛应用于多种类型配体(药物、中药单体/复方、天然产物、代谢物、金属离子和环境污染物等)结合靶标蛋白的鉴定,并可在细胞裂解液和组织层次实现;
七、应用于多种生物样本,包括人源、大鼠、小鼠、植物等生物样本的细胞或组织以及菌体等。
4/ PELSA相对LIP-MS及其它免修饰方法的优势
与已有的限制性酶解-质谱分析(LiP-MS)方法相比将大大降低样品的复杂度,PELSA能鉴定到更多对配体有响应的肽段,更重要的是,PELSA能明显放大靶蛋白配体结合区域的响应。与目前国际上最先进的能鉴定配体结合蛋白和结合区域的限制性酶切方法LiP-Quant技术(LiP-MS的改进版)相比,PELSA鉴定靶蛋白的灵敏度提高了12倍;与目前世界上最广泛使用的鉴定配体结合蛋白的蛋白质热转移分析方法(TPP)相比,PELSA的灵敏度是其1.7-2.4倍,同时克服TPP无法解析结合位点的缺陷(图3)。
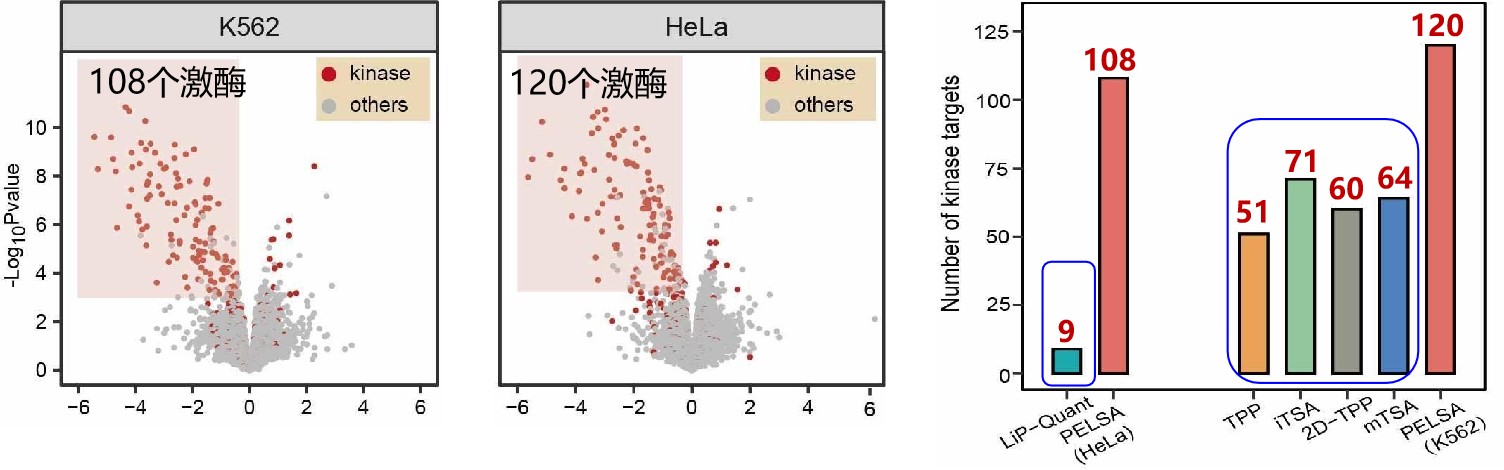
图3. PELSA与其它免修饰方法对Staurosporine靶标的鉴定
5/ PELSA技术可应用领域
一、药物、中药成分、天然产物等小分子结合靶点蛋白的发现,促进新药研发,揭示其作用机制;
二、药物脱靶蛋白鉴定,揭示副作用机制和药物重新利用;
三、疾病生物标志物的发现(如神经退行性疾病中淀粉样蛋白/可溶蛋白的比例);
四、小分子-蛋白、蛋白-蛋白、代谢物-蛋白、肽段-蛋白、环境污染物-蛋白相互作用、位点鉴定及网络分析;
五、研究翻译后修饰与蛋白结构和功能的相关性。
6/ 提供配体-蛋白互作及位点检测(PELSA)对外服务
我们团队对PELSA具有完全的自主知识产权,其中中国专利已经授权。该方法已在药物、中药成分、天然产物、代谢物、金属离子、翻译后修饰肽段和抗体等多个领域中实现了结合蛋白和作用区域的鉴定,取得良好的应用效果。鉴于PELSA技术在靶蛋白鉴定中展现的高灵敏度、技术稳健性及实用价值,我们提供PELSA技术对外服务。
我单位(中国科学院大连化学物理研究所)作为国内唯一提供PELSA技术对外服务的机构,未授权任何第三方公司开展相关业务。对于研究配体与蛋白相互作用和作用区域有需求的老师,欢迎咨询:
张晓磊 博士,邮箱:pelsa_team@163.com