近日,我所生物技术研究部生物分离分析新材料与新技术研究组(1809组)叶明亮研究员、王科云副研究员团队与辽宁师范大学化学与生物学交叉研究中心李国辉教授团队合作,开发了一种基于pH调控的化学新方法,实现了对精氨酸二甲基化异构体的高效区分与功能解析。
精氨酸二甲基化是蛋白质功能调控中一项重要的翻译后修饰,广泛参与基因转录、RNA剪接、DNA损伤应答等关键生物学过程。该修饰包括两种异构体——不对称型二甲基化(aDMA)和对称型二甲基化(sDMA)。尽管二者具有相同的化学式,却表现出不同甚至相反的生物学效应。因此,在开展深入生物学研究前,准确确定它们的具体结构至关重要。目前,常用的特异性抗体富集和中性丢失质谱法在应用中存在局限:前者实验成本高、特异性不足;后者受限于MS/MS谱图中信息化碎片离子产生的随机性。因此,精氨酸二甲基化分析方法在异构体区分方面仍然面临挑战,阻碍了精氨酸二甲基化的功能研究。
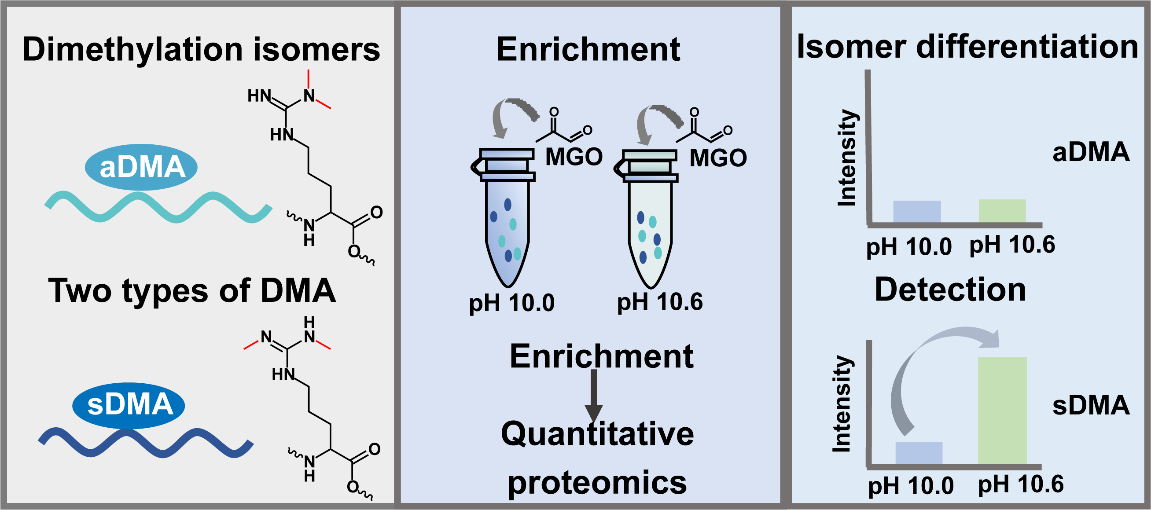
为了克服上述问题,本研究开发的化学方法利用与甲基乙二醛(MGO)的pH调节反应特性来区分二甲基化异构体。研究发现,不同形式的精氨酸甲基化与MGO的反应随pH呈现显著差异:sDMA与MGO反应活性随pH升高显著增强;而aDMA则无明显变化。基于该发现,团队将MGO化学反应与硼亲和色谱技术相结合,建立了一种可同步实现精氨酸二甲基化富集与异构体区分的分析方法。该方法利用精氨酸胍基基团与MGO在不同pH下反应形成顺式二醇结构,通过硼亲和色谱进行富集,实现aDMA与sDMA的精准鉴别。应用该方法,团队确认了SNRPN蛋白R112位点为sDMA修饰,并分别在in vivo和in vitro层次证明其由PRMT5特异性催化。进一步研究发现,该位点的sDMA修饰不仅能显著增强SNRPN蛋白的热稳定性,还直接调控其与SNRPB、SNRPC等多个剪接体核心蛋白的相互作用,进而影响剪接体的组装。这表明sDMA在维持蛋白结构和调控大分子复合物组装中扮演着关键角色。本研究通过将MGO反应的pH敏感性转化为分析工具,建立了精氨酸二甲基化异构体功能蛋白质组学解析的化学平台,为蛋白质甲基化的进一步调控机理研究提供了新路径。
叶明亮团队长期致力于配体靶蛋白质鉴定和蛋白质翻译后修饰新方法的研究,在蛋白质甲基化分析新方法方面取得了一系列进展:发展了精氨酸二甲基化肽段的化学富集方法,揭示了精氨酸二甲基化对蛋白质液-液相分离具有重要的调控作用(PNAS,2022);在此基础上利用甲基化不易被酶切的特点,建立了能实现精氨酸甲基化三种形式同时富集分析的酶化学富集新方法,提高了精氨酸甲基化的鉴定覆盖度(Anal. Chem.,2024);此外,建立了能同时鉴定8种氨基酸甲基化的代谢标记方法,确定了CARNMT1为C3H1锌指蛋白的甲基转移酶,并且发现U2AF1上的组氨酸甲基化修饰会显著影响pre-mRNA的可变剪接(Nat. Commun.,2024)。
相关成果以“Decoding Arginine Dimethylation Isomers via pH-Tuned Reactivity with Methylglyoxal: A Chemical Approach for Functional Proteomics”为题,于近日发表在《美国化学会志》(Journal of the American Chemical Society)上。上述工作得到国家重点研发计划、国家自然科学基金、我所创新基金等项目的支持。(文/图 王佳怡)
文章链接:https://pubs.acs.org/doi/full/10.1021/jacs.5c14304