近日,我所生物技术研究部生物分离分析新材料与新技术研究组(1809组)叶明亮研究员团队开发了一种名为“溶剂诱导细胞部分固定法”(Solvent-Induced partial Cellular Fixation Approach,SICFA)的蛋白质组学新方法。该方法可在活细胞中原位、高通量地识别药物结合靶点及其下游早期效应蛋白,并揭示药物作用在细胞内的动态调节顺序。其核心优势在于无需裂解细胞,在保持细胞结构完整性的条件下实现对药物早期分子事件的系统解析,为药物机制研究和临床前药效评估提供了有力的技术工具。
药物在细胞内的作用是一个多级联过程:起始于药物与靶蛋白的直接结合,继而引发下游信号通路的级联反应,随后诱导基因表达与蛋白质水平的变化,最终导致细胞表型发生显著改变。其中,早期的靶点结合等分子事件通常仅涉及构象变化,此类动态改变难以通过传统定量蛋白质组学技术捕捉。近年来,热蛋白质组分析(TPP)、溶剂诱导沉淀(SIP)等方法虽实现了高通量靶标筛选,但TPP对耐热靶点的检测灵敏度不足,而SIP等化学变性方法依赖裂解液样品,无法真实反映药物在完整细胞中的渗透、代谢及下游效应的时空动态。
针对上述技术瓶颈,在本工作中,研究团队另辟蹊径,开发了SICFA方法。该方法基于有机溶剂对细胞内蛋白质的部分固定作用,通过梯度浓度固定剂处理活细胞,诱导蛋白质在细胞内原位发生可控、梯度的变性聚集,再结合定量质谱分析可溶蛋白的含量,系统评估细胞内蛋白质稳定性的变化。其核心优势在于,在保持细胞结构完整的前提下,同步鉴定药物的直接作用靶点和下游早期效应蛋白。
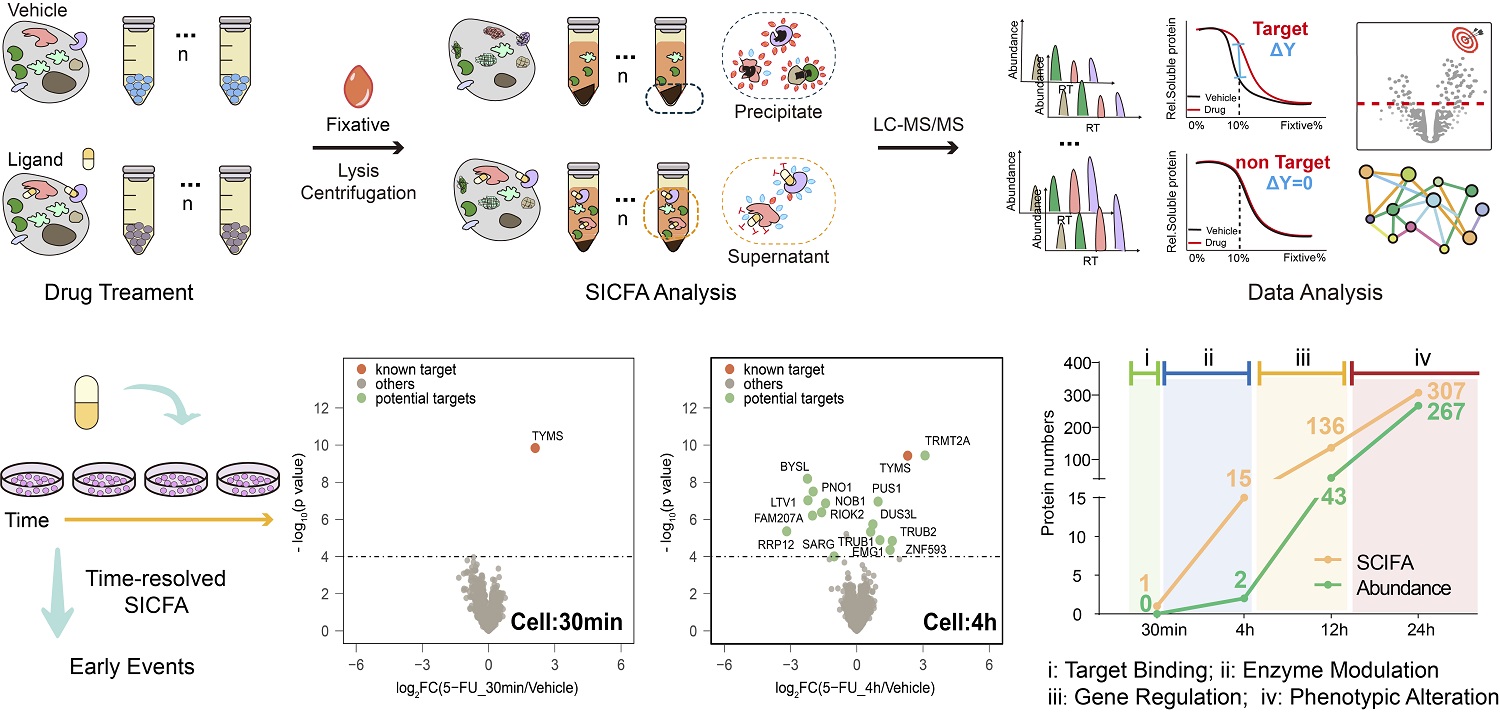
研究证实,SICFA在多种药物模型中表现出优异性能:不仅精准识别了雷替曲塞、达沙替尼等药物的已知靶点,还检测到已知靶点互作蛋白的稳定性变化,揭示了更加丰富的药物作用网络信息。通过时间分辨SICFA实验,团队进一步解析了药物作用的时序特征。例如,在5-氟尿嘧啶(5-FU)处理的人源细胞模型中,SICFA在用药后4小时检测到多个RNA转录后修饰酶(例如PUS家族、TRMT2A等)的稳定性改变,而传统方法此时尚不能检测到蛋白表达量及RNA修饰水平的变化,说明蛋白质稳定性的分析阐明了5-FU的早期作用机制集中于RNA修饰调控通路。
SICFA方法具有操作简便、通量高的特点,可与免疫印迹、质谱蛋白质组学、微孔板荧光检测等多种技术联用,适用于大规模药物筛选和机制研究。未来,该方法还有望拓展至代谢物、环境污染物等多种配体的作用机制解析,在药物研发、毒理学评估和生命科学基础研究中具有重要应用潜力。
近年来,叶明亮团队在靶标蛋白质组学方法领域持续创新,开发了以肽段为中心的蛋白质局部稳定性探测方法(PELSA)(Nat. Methods,2024)和基于赖氨酸反应活性的分析方法(Anal. Chem.,2022);pH沉淀(pHDPP)、有机溶剂沉淀(SIP)、机械力诱导蛋白沉淀(MSIPP)等基于变性稳定性分析方法(Chem. Sci.,2022;Anal. Chem.,2020;Anal. Chim. Acta.,2021);矩阵热迁移分析方法(mTSA)(Anal. Chem.,2022);微球辅助的热致蛋白沉淀(MAPS)(Anal. Chem.,2020)方法等。这些方法已应用于中药紫草素、双氢青蒿素、持久性污染物全氟辛磺酸、代谢物及肽段的靶蛋白鉴定研究。
上述研究成果以“Solvent-induced partial cellular fixation decodes proteome-wide drug targets and downstream pathways in living cells”为题,于近日发表在《自然-通讯》(Nature Communications)上。该工作的第一作者是1809组博士研究生于婷。上述工作得到了国家重点研发计划、国家自然科学基金、我所创新基金等项目的支持。(文/图 于婷)
文章链接:https://doi.org/10.1038/s41467-025-65497-2